
时间:2020-12-24 13:50:15来源:第一财经
在中国国药集团已向国家药监局提交了新冠疫苗上市申请1个月后,国家药品监督管理局药审中心公布了其受理号,正式宣布国药中生北京生物制品研究所的新冠病毒灭活疫苗(Vero)上市申请获得国家药品监督管理局受理。
新冠疫苗一直行进在中国药品特殊审批程序通道中,由此,附条件上市时间可期。
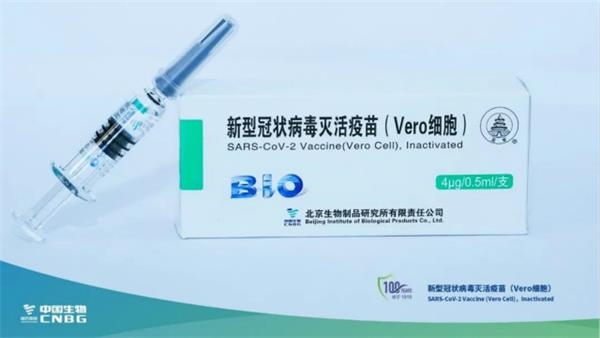
附条件上市、可及性可期
疫情发生后,国家药监局立即启动应急审批程序,按照“统一指挥、早期介入、随到随审、科学审批”的原则和确保产品安全、有效、质量可控的要求,全力对新冠肺炎的相关产品加快了审评审批速度,不仅是器械、药品、诊断试剂,还有新冠疫苗。
国家药品监督管理局副局长陈时飞曾在联防联控机制举行的新闻发布会上介绍,新冠肺炎疫情发生以来,国家药监局科学、有序、精准地开展了新冠肺炎防控药品应急审批工作。一是第一时间依法启动了应急审批工作机制,组建了以院士为核心的专家组,专家组有来自药学、药理、毒理、临床各方面国内知名的专家,确定了统一指挥、早期介入、随到随审、科学审批的工作原则。
“国家药监局特别重视疫苗的研发进展,为此特别组织了专家团队,逐一对接科研攻关组,推进疫苗重点项目。在疫情防控的特殊时期,审评团队做到提前介入指导服务,同步跟进研发进程。对于安全有效质量可控的药品和疫苗,国家药监局将会争分夺秒完成技术审评,第一时间批准用于抗击新冠肺炎。”陈时飞曾表示。
中国新冠疫苗的研发轨迹也是国家药审中心专家审批的轨迹,试验数据一旦出现结果,即可进入批准环节。
这个速度会有多快?
“如果是按照特殊时期的审批,叫滚动式的方式,交了材料及时看,看完需补交材料的马上补充不需要再次排队,这是专对特殊时期的,如果快的话,两三天就好了。”一位药品领域专家表示。
按照《新药注册特殊审批管理规定》,特殊审批管理规定将特殊审批设置为单独通道,优先保证特殊审批新药注册申请全过程的审评审批,并按《药品注册管理办法》规定的时限完成。当存在发生突发公共卫生事件的威胁时,以及突发公共卫生事件发生后,对突发公共卫生事件应急处理所需新药按照《国家食品药品监督管理局药品特别审批程序》办理。
新冠疫苗走特殊审批通道,其批准的速度到底多快,还有待验证。但通过已有优先审批审批案例看,非特殊审批通道的HPV疫苗,在优先审批通道上,8天即获得了批准。
4月28日,国家药品监督管理局有条件批准用于预防宫颈癌的九价人乳头状瘤病毒疫苗(下称HPV疫苗)上市。距离默沙东提交申请日4月20日只过去了8天。
“从药审中心受理时间到元旦还有9天,与优先审评审批相比,特殊审批有可能会超越这个速度,不过上市条件应该还是与HPV相同,附条件上市,毕竟三期临床试验尚未结束。”一位药企负责人表示。
除了上市时间可期之外,新冠疫苗的可及性范围也将扩大。新出台的《生物制品批签发管理办法》也为新冠疫苗上市铺平了道路。
12月21日,国家药监局公布《生物制品批签发管理办法》。这份文件在业内广受关注,最重要是因为提出了“预防、控制传染病疫情或者应对突发事件急需的疫苗,经国家药品监督管理局批准,免予批签发”。
目前,中国的批签发流程是60天。而新的政策授予了新冠疫苗这样的产品免于60天批签发的条件。这意味着,今后若遇到突发性公共事件,相关疫苗生产企业将不受批签发制度的影响,通过药监审批即可向市场供应。
期待数据透明
中国科学界内,对于新冠病毒相关科学数据一直都满怀期待。
12月10日,美国FDA对辉瑞新冠疫苗进行专家评审,全天在网络上直播,把数据都展示给公众,评审后将进行专家投票,这种透明度给予公众带来的是信任和信心。
“审批程序必须公开透明并以科学为基础,希望也能看到中国新冠疫苗完全的研发试验数据。”上述药企负责人表示。
声明:文章仅代表原作者观点,不代表本站立场;如有侵权、违规,可直接反馈本站,我们将会作修改或删除处理。
图文推荐
2020-12-24 12:49:04
2020-12-24 11:50:33
2020-12-24 10:49:52
2020-12-24 10:49:05
2020-12-24 08:49:05
2020-12-23 14:51:54
热点排行
精彩文章
2020-12-24 12:49:14
2020-12-23 16:50:52
2020-12-23 15:49:55
2020-12-23 14:52:09
2020-12-23 14:51:27
2020-12-23 13:50:22
热门推荐
